《中国银屑病生物治疗专家共识(2019 版)》解读
银屑病是一种免疫介导的炎症性疾病,由于其病情常年反复,难以根治,故治疗目的以控制临床症状,逐步改善患者的生活质量为主[1]。目前针对银屑病治疗的个体化方案和临床药物众多,但患者普遍对治疗效果并不十分满意。生物治疗时代逐步进入临床,其在中、重度,难治及特殊类型的银屑病患者人群中得到广泛应用,且取得了较为满意的临床疗效。
由于我国银屑病患者人群有较高的乙型肝炎和结核病患病率,对生物制剂的临床应用造成了一定的局限性。因此《中国银屑病生物治疗专家共识(2019 版)》[2](后文简称共识) 的关键之处如下。
(1) 满足综合皮肤科医师的临床应用需求;
(2) 详细介绍了已批准上市的生物制剂种类、使用原则和方法、临床疗效和安全性、患者用药前筛查和治疗后监测、常见问题和处理对策,以及特殊人群用药的注意事项等内容;
(3) 依据国际上已发表的生物制剂治疗指南和专家共识,共识结合国内外银屑病生物制剂治疗的真实研究数据并参考银屑病诊疗领域专家的个人临床经验,提出具备临床指导意义的规范化生物制剂治疗方案。
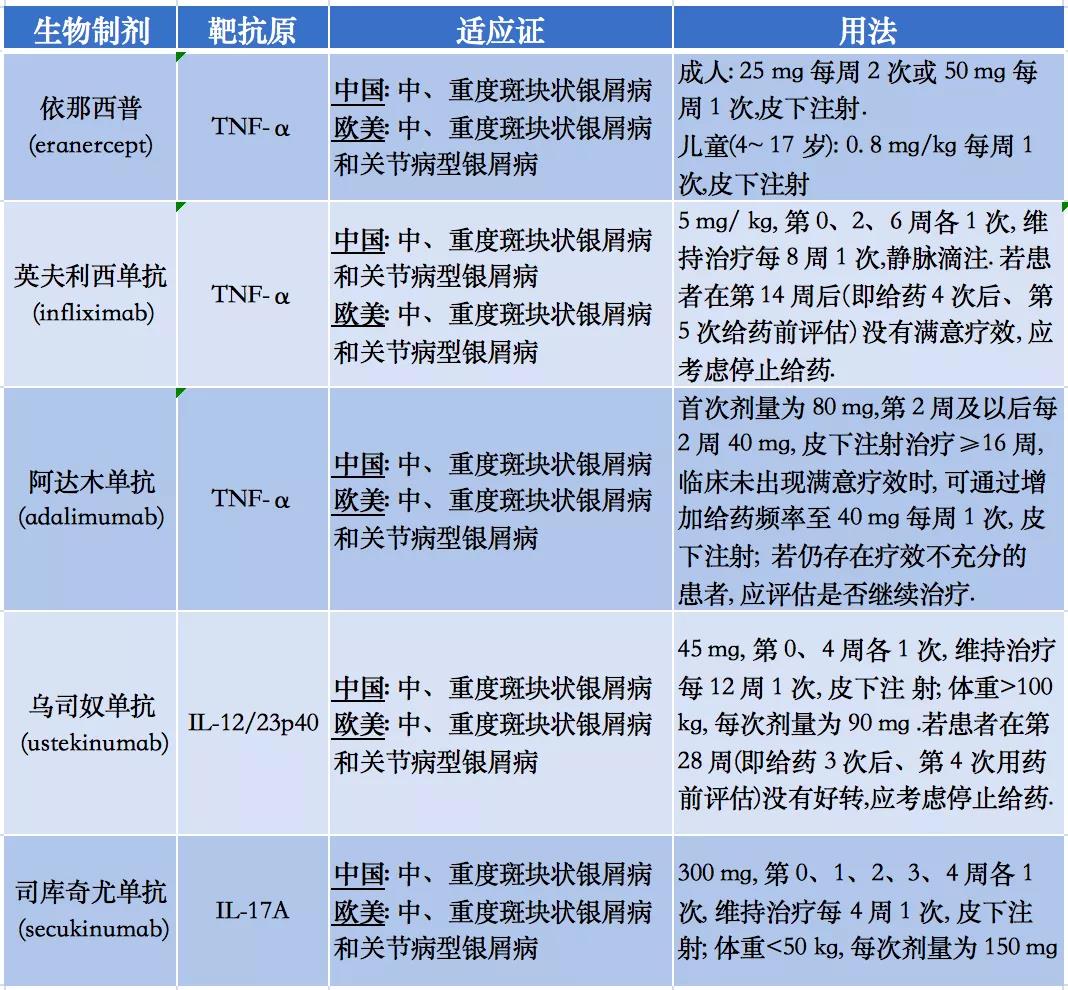
该共识根据成分、具体用法及适应证对我国获批上市且已在临床用于银屑病治疗的生物制剂进行了总结,见表 1 。此外,对于以下特殊情况,在临床实际应用过程中仍可考虑生物制剂治疗 :
(1) 在超适应证用药方面,包括泛发性脓疱型、红皮病型银屑病等,可根据患者病情酌情使用;
(2) 疾病给患者带来重大健康风险或对生活质量有重大影响时。
该共识突出了生物制剂治疗前的筛查及治疗过程中的安全性监测指标,主要包括:
(1) 血常规、肝肾功能、乙型肝炎病毒(hepatitis B virus,HBV) 和丙型肝炎病毒(hepatitis C virus,HCV)[3]、结核菌素试验(tuberculin pure protein derivative, PPD) 或结核感染 T 细胞检测(T-Spot)或结核分枝杆菌特异性细胞免疫反应检测 (QuantiFERON-TB Gold,QFT)以及胸部 X 线或 CT 等[4];
(2) 有高危险因素者需筛查人类免疫缺陷病毒 (human immunode-ficiency virus, HIV);
(3) 育龄期女性需筛查尿妊娠试验;
(4) 拟用 TNF-α 抑制剂者筛查抗核抗体,同时评估患者有无心功能不全等情况[5];
(5) 拟用 IL-17A 抑制剂者筛查有无系统性真菌感染、炎症性肠病,并关注以上疾病相关家族史情况[6]。
就各生物制剂用药期间各指标监测频率而言,英夫利西单抗、乌司奴单抗于每次注射前,依那西普、阿达木单抗、司库奇尤单抗在第 2、4 周及以后每 3 个月检查 1 次血常规和肝功能;HBV、HCV 筛查阳性者根据情况每 3~6 个月检查 1 次;TNF-α 抑制剂每半年检查 1 次,其他生物制剂则每年检查 1 次抗核抗体、T-Spot或 PPD 或 Quantiferon Gold、胸部 X 线或 CT。
该共识新增了生物制剂治疗过程中药物疗效衰退的原因和具体机制、应对策略和治疗转换等方面的内容。目前生物制剂在临床应用过程中存在不同程度的疗效衰退现象,追其根本是因为继发性治疗失败,主要概括为以下几点:
(1) 给药剂量不足;
(2) 产生抗药抗体;
(3) 银屑病患者对药物的敏感性降低。
生物制剂针对其疗效衰退现象,临床上可采取以下相关应对措施:
(1) 治疗加量,在安全用药范围内增加生物制剂的剂量或缩短用药间隔;
(2) 联合治疗,联合糖皮质激素药膏和维生素 D3衍生物;联合短期紫外线光疗;首选联合的系统治疗药物为甲氨喋呤,可联合服用阿维 A,但并不推荐联合服用环孢素,乃至其他免疫抑制剂;不主张两种生物制剂联合使用;
(3) 治疗转换,可换用靶点相同或不同的其他生物制剂;根据患者实际病情,酌情停用原生物制剂 3~4 个半衰期后启动新的生物治疗;若考虑停用生物治疗,继而转换为传统治疗方法时,则无需间隔时间。
银屑病反复发作、迁延不愈,结合我国国情、患者经济承受能力、对生活质量的需求,以及治疗安全性等综合因素,该共识详尽介绍了生物制剂停药、维持和再次启动治疗的时机:
(1) 重度、顽固性患者、伴严重关节损害者及影响生活质量者,该共识建议尽可能选择长期维持治疗;
(2) 治疗应答率维持 6 个月以上时,全面评估后可考虑停药,主要通过逐步减少单次剂量或增加用药间隔来实现。
临床上存在部分患者停药后因病情加重,需要再次启动生物治疗的,具体建议:
(1) 病情反复较轻者可采用维持治疗方案;
(2) 病情较重者可选择与初次同样的负荷治疗剂量重新诱导(依那西普除外);
(3) 鉴于较高的过敏发生率,英夫利西单抗可按照维持治疗方案再次给药,通常不推荐再次进行诱导治疗。
针对银屑病生物制剂用药的特殊人群,包括妇儿、乙型肝炎、结核等感染、恶性肿瘤、疫苗接种和外科手术等患者,该共识详细介绍了生物制剂的选择以及使用过程中的注意事项、禁忌等方面。
该共识对妊娠期及计划妊娠患者、儿童患者使用生物治疗的过程中,提出建议如下:
(1) 一般认为应用 TNF-α 抑制剂是安全的,但需注意其增加感染的风险;
(2) 妊娠期泛发性脓疱型银屑病患者在治疗过程中出现对系统糖皮质激素、环孢素治疗无效、存在禁忌证、病情危及生命等情况,可权衡使用TNF-α 抑制剂;
(3) 计划妊娠者,孕前需遵循各生物制剂的停药时间;
(4) 哺乳期患者,可在治疗后 20周内停止母乳喂养或停止生物制剂治疗(其中英夫利昔单抗和乌司奴单抗在哺乳期禁用,司库奇由单抗使用需权衡利弊);
(5) 中、重度斑块状银屑病患儿,可选用阿达木单抗(EMA 获批4岁以上)、依那西普(EMA获批6岁、FDA 获批4~17岁)及乌司奴单抗(EMA 获批12岁以上),英夫利西单抗和司库奇尤单抗目前尚未获批其儿童患者用药的适应证。
目前,我国仍属于乙型肝炎和结核病大国,在使用生物制剂时须尤为重视。对于乙型肝炎患者,该共识认为:
(1) 使用生物制剂前,首先必须明确 HBV、HCV 的感染状态和肝功能情况;
(2) HBV 抗原抗体检测全为阴性者,可进行生物治疗;
(3) 乙型肝炎病毒表面抗体(hepatitis B virus surface antibody,HBsAb)阳性或伴乙型肝炎病毒核心抗体(hepatitisB virus core antibody, HBcAb)阳性,则进一步检测乙型肝炎病毒 DNA 定量检测(HBV-DNA) 判断能否行生物治疗;结果阴性,可进行生物治疗;结果阳性,需慎行生物治疗;
(4) 乙型肝炎病毒表面抗原(hepatitis B virus surface antigen, HbsAg)阳性,需结合HBV DNA、乙型肝炎病毒 e 抗原(hepatitis B virus eantigen, HBeAg)或乙型肝炎病毒 e 抗体(hepatitis Bvirus e antibody, HBeAb)结果判断能否行生物治疗;伴 HBV 高度复制(>105 拷贝/ mL)和/ 或 HBeAg 阳性者,不宜行生物治疗;HBV 轻度复制( <104 拷贝/mL),伴肝功能异常者,不宜行生物治疗;HBV 无复制且肝功能正常者,必要时联合抗 HBV 治疗,需权衡利弊后慎行生物治疗[7];
(5) 治疗过程中,根据各生物制剂要求监测肝功能、HBV 抗原抗体和HBV DNA 水平,以保证生物治疗过程的安全性。
对于结核患者,该共识建议:
(1) 禁用于已知的活动性感染患者;
(2) 慎用于非活动性结核和潜伏结核患者,必要时应在治疗前进行预防性抗结核治疗[8],具体抗结核方法可参考最新的WHO结核病治疗指南;
(3) 在预防性抗结核治疗至少 4 周后方可进行生物治疗;
(4) 生物制剂用药期间或之后需严密监测患者是否出现活动性结核的症状和体征,并定期予以胸部 X 线/ CT、PPD / T-spot 等检查,协助临床评估继续用药与否;
(5) 应用 TNF-α 抑制剂者和结核高危人群,建议适当增加随访频率,以便于临床评估。
对有需要接种疫苗的患者,该共识认为:
(1) 避免接种活疫苗,可选用重组疫苗或灭活疫苗;
(2) 必须接种活疫苗者,需间隔各生物制剂的半衰期,但至少停用生物制剂4周;
(3) 婴儿至少在出生6个月内避免接种活疫苗(针对母亲在妊娠16周后有生物治疗史的情况);
(4) 需停用生物制剂12个月,方可接种带状疱疹活疫苗。
该共识指出,尚无明确证据表明生物制剂会增加恶性肿瘤发生的风险,但考虑到其有导致肿瘤进展的潜在可能性,因此应权衡病情谨慎使用。根据该共识建议,银屑病合并肿瘤患者在以下几种情况下,经过严密监测并全面评估病情后,可酌情使用生物制剂:
(1) 恶性肿瘤已行根治手术 5 年以上、目前明确无复发和转移的情况[9-10];
(2) 长期使用长波紫外线( ultraviolet A, UVA) 或补骨脂素联合长波紫外线照射治疗(bath psoralen plus ultraviolet A,PUVA),已排除皮肤癌发生者;
(3)免疫抑制剂联合生物制剂应用者,临床和实验室均排除肿瘤发生及复发的情况;
(4) 已排除淋巴系统恶性肿瘤者。对于要进行外科手术的银屑病患者而言,生物制剂理论上确实有可能增加感染的风险,最终影响伤口愈合等情况。因此,低风险手术者生物治疗不受影响,中、高风险手术者须先停用生物制剂 3 ~ 5 个半衰期后,方可进行择期手术[11-12]。
综上所述,2019 版银屑病生物治疗专家共识认为,如何通过规范化、安全化使用生物治疗,进而提高临床疗效,已逐步成为临床医生尤为关注的问题,因此须以临床应用需求为出发点,以控制症状、改善患者生活质量为目标,提出具体的指导意见。此共识新增了患者的筛查与监测原则,首次针对常见问题与对策提出了说明,详细介绍了特殊人群用药的注意事项等。对于我国银屑病伴乙型肝炎和结核患者,该共识着重指出了预防性抗病毒和预防性抗结核治疗的方案,为该类特殊人群患者提供了更安全有效的治疗方案;对于银屑病妊娠患者,该共识认为TNF-α抑制剂相对可安全应用,但由于目前赛妥珠单抗在我国尚未上市,因此银屑病妊娠患者的临床用药仍是一个迫在眉睫的难题。
2019 版共识结合国内外目前生物制剂应用的研究数据和临床经验进行了总结,提出了符合中国特色的银屑病生物治疗。随着人类社会的不断进步,医学科学事业的不断拓展,期待生物制剂治疗方案能够不断推陈出新,将来更好地为银屑病等免疫介导的炎症性皮肤病提供更多帮助。
THE END