Psoriasis News

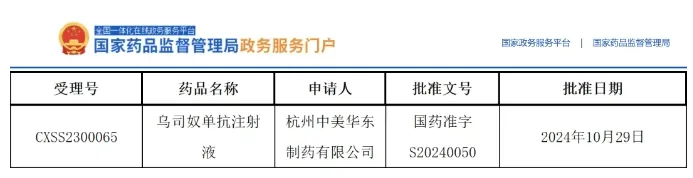
这是国内首个获批上市的国产乌司奴单抗,为众多深受银屑病困扰的患者带来新的治疗选择。在这个意义非凡的时刻,特邀赛乐信®Ⅲ期临床试验主要研究者,皮肤病学领域权威专家北京大学人民医院张建中教授,探讨银屑病诊疗现状及进展,聚焦银屑病患者亟待解决的需求。
北京大学人民医院 张建中教授
张建中教授指出,银屑病(牛皮癣)是皮肤科常见疾病,治疗难度大、病程迁延不愈,严重影响生活质量。研究结果显示:我国65%的银屑病患者病程可达10年以上,平均复发次数为8次,近六成患者皮损反复发作10次以上;对患者身心健康、日常学习、工作和社交造成了严重影响[1]。
张建中教授指出,中国银屑病治疗步入生物制剂时代,相较于传统治疗,生物制剂通常具有更优的疗效和良好的安全性。如今银屑病皮损的良好控制已不再是该疾病的治疗难点,但在银屑病长期管理方面,仍存在挑战。一项患者调研表明超半数患者对目前治疗方案的疗效和安全性较为满意,但在治疗便捷性和费用上的满意度较低[2]。综上,临床及患者端对银屑病的治疗需求均已从快速清除皮损向寻求长期综合获益转变。

张建中教授指出,乌司奴单抗(赛乐信®)是目前给药间隔最长的治疗药物之一,首年给药五剂,维持期每年四剂,即可实现银屑病长期临床缓解,减少疾病复发;显著减少患者就医次数,提高用药依从性,减轻治疗负担,提高患者生活质量。
赛乐信®与原研乌司奴单抗的头对头研究结果显示,治疗第12周,赛乐信®组达到PASI 75应答率为70.4%,原研乌司奴单抗组为64.3%;赛乐信®组达到 IGA 0/1应答率为62.8%,原研乌司奴单抗组为56.1%;治疗第52周,赛乐信®组达到PASI 75应答率为80.6%,原研乌司奴单抗组为74.9%[3];治疗期严重不良事件发生率为4.0%,原研乌司奴单抗发生率为5.1%;总体安全性良好,两组安全性相似。
赛乐信®为全人源IgG1单克隆抗体,表达平台为中国仓鼠卵巢细胞[4],与原研表达平台小鼠骨髓瘤细胞相比,基本不含唾液酸化组分,免疫原性风险更低;同时,头对头研究显示:与原研乌司奴单抗相比,赛乐信®抗药物抗体发生率显著降低[3]。
最后,张建中教授表示赛乐信®将为中国银屑病患者带来更优质的治疗选择,热烈祝贺首个国产乌司奴单抗(赛乐信®)成功上市!

END
[2]Rigopoulos D, Ioannides D, Chaidemenos G, Kallidis P, Voultsidou A, Matekovits A, Soura E. Patient preference study for different characteristics of systemic psoriasis treatments (Protimisis). Dermatol Ther. 2018 May;31(3):e12592. doi: 10.1111/dth.12592. Epub 2018 Feb 6. PMID: 29405519.
[3]QX001S-CSR 3期临床研究报告重点数据(CTR20211036).
[4]Gao L, Li Q, Zhang H, Wu M, Fang M, Yang L, Li X, Liu J, Li C, Chen H, Zhu X, Ding Y, Zhou M. A Biosimilarity Study Between QX001S and Ustekinumab in Healthy Chinese Male Subjects. Front Pharmacol. 2021 May 18;12:675358. doi: 10.3389/fphar.2021.675358. PMID: 34084144; PMCID: PMC8167066.
★免责声明:本文信息仅供向医疗卫生专业人士提供科学信息,不可直接作为决策内容,得码学苑不对任何主体因使用本文内容而导致的任何损失承担责任。以上内容如涉版权请联系删除。










Leave a Reply