
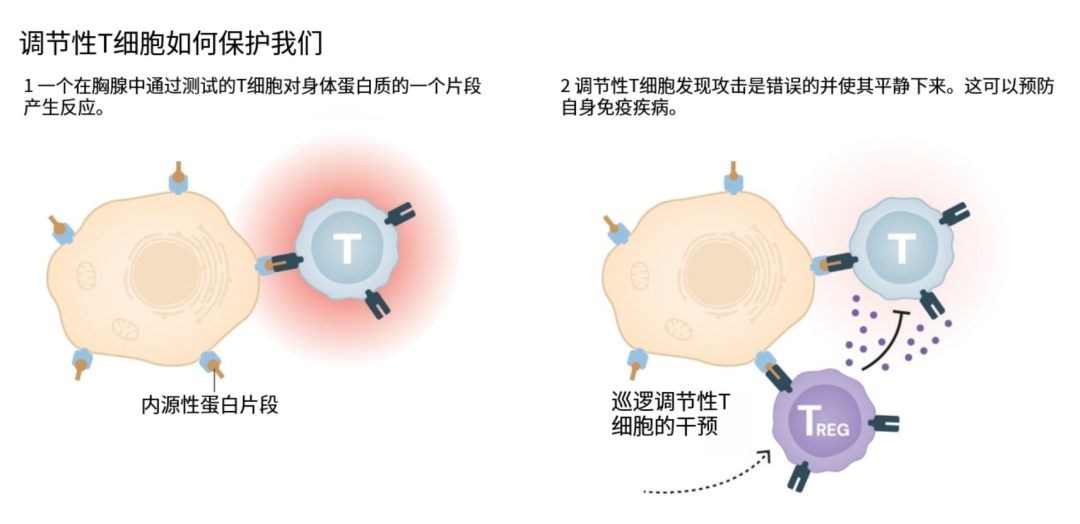
1995年,坂口志文的研究彻底打破了这一单一认知。他通过实验发现,小鼠体内存在一类此前未被识别的特殊免疫细胞,缺失这类细胞的小鼠,会出现胰腺、甲状腺等多个器官受损的自身免疫性疾病。这一成果证明,免疫系统的调控远比想象中复杂,这类能“保护身体不攻击自己”的细胞,就像免疫系统的“安保人员”,默默守护着机体稳定。后来,这类细胞被正式命名为“调节性T细胞”(Treg),为免疫学研究开辟了全新方向。

当时,二人针对某一品系极易患自身免疫病的小鼠展开研究,最终锁定了关键的基因突变:FOXP3 基因异常会导致小鼠免疫系统失控,引发严重的自身免疫问题。更重要的是,他们进一步证实,人类体内的 FOXP3 基因若发生突变,会引发罕见且凶险的“免疫失调性多内分泌病肠病 X 连锁综合征(IPEX 综合征)”,这类疾病主要影响男性患者,会同时攻击内分泌、肠道等多个系统,此前缺乏有效的针对性治疗思路。
2003年,坂口志文团队的后续研究则将两大发现紧密串联:他们证实,FOXP3 基因正是调控调节性T细胞发育的核心“开关”—— 只有 FOXP3 基因正常工作,调节性T细胞才能正常生成并发挥“安保”作用。这一结论不仅完善了外周免疫耐受的理论体系,更让人类对免疫系统调控的理解迈入了“精准分子层面”。

对于自身免疫性疾病患者而言,调节性T细胞功能异常或 FOXP3 基因缺陷是疾病发作的关键原因。如今,科学家可通过调控调节性T细胞活性、修复 FOXP3 基因功能等思路,开发针对性疗法,从“根源”上调节免疫系统,而非单纯用药物压制免疫反应(传统治疗常伴随免疫力下降等副作用)。
2025年诺贝尔生理学或医学奖的揭晓,既是对三位研究者的致敬,更是对免疫学领域未来发展的期许。随着对调节性T细胞、FOXP3 基因研究的不断深入,我们有理由相信,未来会有更多针对自身免疫病、癌症的精准疗法问世,为万千患者带来“治愈”的希望。而这,正是科学探索最动人的意义 —— 用智慧与坚持,守护人类健康!

助力皮肤健康